informacion quimica
lunes, 2 de octubre de 2017
Tabla Periodica
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Dmitri Mendeléyev publicó en 1869 la primera versión de tabla periódica que fue ampliamente reconocida. La desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.
Estados de la materia
Estado sólido |
Métodos de separación de mezclas
SEPARACIÓN MAGNÉTICA
Habrás pensado que la forma más rápida y efectiva de separar el hierro del aluminio es recurrir a un imán (si no tuvieras ninguno podrías improvisarlo, ya que muchos cierres de bolsos y tapas de carcasas protectoras de móvil son imanes). Puesto que el hierro es atraído por el imán pero el aluminio no, habrás solucionado el problema de una manera sencilla.
El método empleado en este caso para separar los componentes de tu mezcla heterogénea recibe el nombre de separación magnética. Solo puede emplearse si uno de ellos presenta propiedades magnéticas (como el hierro) y el resto no.
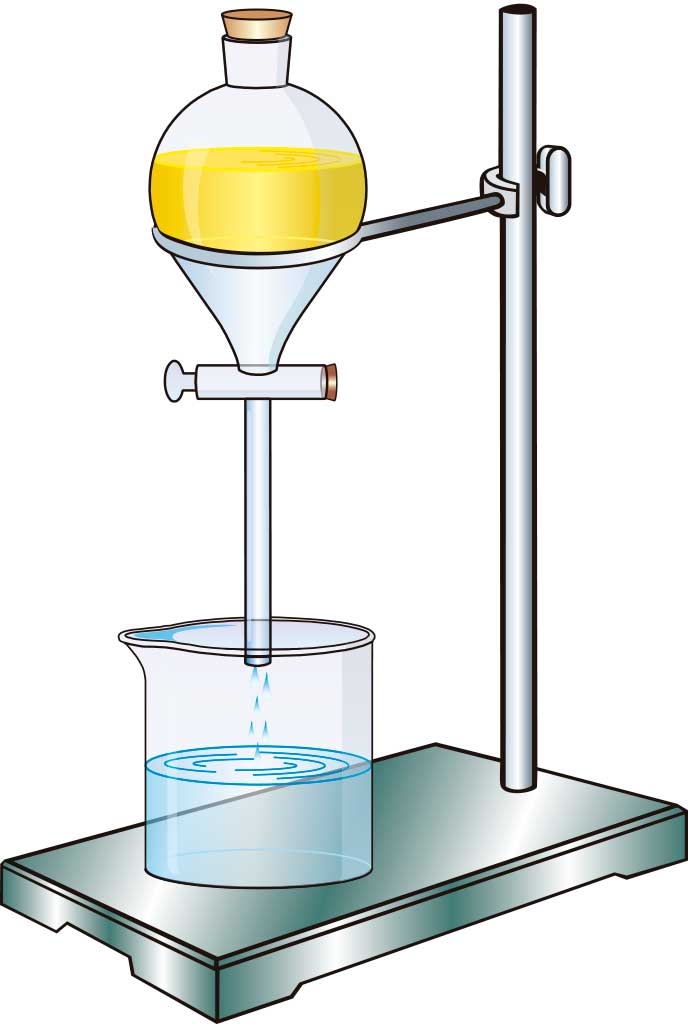
DECANTACIÓn :
Se emplea para separar líquidos con densidades diferentes y que no se mezclan entre sí (inmiscibles), como el agua y el aceite. En estos casos, se utiliza un embudo de decantación.
FILTRACIÓN
Este método se usa para separar un sólido de un líquido en el cual no se disuelve (no es soluble en él), como la arena en suspensión en el agua. Para ello, se hace pasar la mezcla heterogénea a través de un filtro con un tamaño de poro adecuado (menor que el de las partículas que queremos separar). Habitualmente se emplea un papel de filtro acoplado a un embudo.
EVAPORACIÓN Y CRISTALIZACIÓN
Se emplea para separar un soluto sólido disuelto en un disolvente líquido, como la sal en el agua. El proceso comienza con la evaporación del disolvente (natural o forzada mediante calefacción) y acaba con la deposición en el fondo del recipiente (generalmente, un cristalizador) del sólido en forma de cristales. Cuanto más lenta sea la evaporación del disolvente, más grandes serán los cristales.
Configuración electrónica
Vamos a estudiar la configuración electrónica o también llamada distribución electrónica. Abajo del todo tienes una tabla con la configuración electrónica de todos los elementos, pero aqui vamos a explicarte como se hace.
Primero te vamos a explicar todo de forma sencilla para que lo entiendas. Luego te enseñaremos una regla muy sencilla para obtener la configuración electrónica de cualquier elemento, pero es bueno que intentes entender el cómo y el por qué. Por eso empezaremos por el principio para que nos resulte fácil.
 Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
Primero te vamos a explicar todo de forma sencilla para que lo entiendas. Luego te enseñaremos una regla muy sencilla para obtener la configuración electrónica de cualquier elemento, pero es bueno que intentes entender el cómo y el por qué. Por eso empezaremos por el principio para que nos resulte fácil.
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita? Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica. Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?. Por ejemplo, es muy útil o mejor dicho imprescindible para hacer el enlace covalente y los enlaces iónicos y conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel).
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita? Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica. Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?. Por ejemplo, es muy útil o mejor dicho imprescindible para hacer el enlace covalente y los enlaces iónicos y conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel).
mezclas quimicas (homogeneas y heterogeneas)
¿Qué es una Mezcla?
Una mezcla es una sustancia que está formada por varios componentes (dos o más), que no pierden sus propiedades y características por el hecho de mezclarse ya que no se produce una reacción química entre ellos. ejemplos de mezclas pueden ser una ensalada, agua salada (agua y sal), azúcar y sal, etc.Tenemos dos tipos de mezclas diferentes.
- Homogéneo : Cuando todos los elementos que forman una agrupación son iguales (una manada de cebras serán todas iguales). No se diferencian unos de otros. En químicacuando una sustancia tiene una composición uniforme.
*Recuerda, Sustancia = Material constituido por un solo componente y con las mismas propiedades en todas sus partes,. Por ejemplo hierro puro, si todo el material son átomos de hierro, será una sustancia, sustancia pura.
*Recuerda, Sustancia = Material constituido por un solo componente y con las mismas propiedades en todas sus partes,. Por ejemplo hierro puro, si todo el material son átomos de hierro, será una sustancia, sustancia pura.

- Heterogéneo : Agrupación de elementos desiguales, se pueden diferenciar. En químicaaquel material en el que se pueden diferenciar las fases o partes que la componen (varias sustancias o componentes).
Bien ahora que ya tenemos claro las definiciones pasamos a explicar las mezclas homogéneas y heterogéneas. Lo primero de todo saber que es una mezcla
A continuacion un video acerca del tema:
Suscribirse a:
Entradas (Atom)